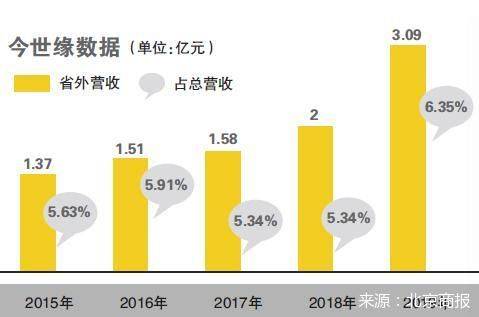
еҺҹе§Ӣж Үйўҳ жңүеҶ…жғ…пјҒз ”з©¶жңәжһ„дёәдҪ•з”іиҜ·з‘һеҫ·иҘҝйҹҰдёӯеӣҪдё“еҲ©пјҹ 2жңҲ4ж—Ҙ пјҢ дёӯ科йҷўжӯҰжұүз—…жҜ’жүҖе®ҳзҪ‘еҸ‘еёғж¶ҲжҒҜз§° пјҢ дёӯеӣҪ科еӯҰйҷўжӯҰжұүз—…жҜ’з ”з©¶жүҖ/з”ҹзү©е®үе…ЁеӨ§з§‘еӯҰз ”з©¶дёӯеҝғгҖҒеҶӣдәӢ科еӯҰйҷўеҶӣдәӢеҢ»еӯҰз ”з©¶йҷўеӣҪ家еә”жҖҘйҳІжҺ§иҚҜзү©е·ҘзЁӢжҠҖжңҜз ”з©¶дёӯеҝғ пјҢ еңЁ1жңҲ21ж—Ҙз”іжҠҘдәҶз‘һеҫ—иҘҝйҹҰпјҲRemdesivirпјүзҡ„дёӯеӣҪеҸ‘жҳҺдё“еҲ©пјҲжҠ—2019ж–°еһӢеҶ зҠ¶з—…жҜ’зҡ„з”ЁйҖ”пјү пјҢ 并е°ҶйҖҡиҝҮPCTпјҲдё“еҲ©еҗҲдҪңеҚҸе®ҡпјүйҖ”еҫ„иҝӣе…Ҙе…Ёзҗғдё»иҰҒеӣҪ家 гҖӮ

еңЁеҜ№жҠ—ж–°еҶ з—…жҜ’зҡ„зү№ж•ҲиҚҜдёӯ пјҢ з‘һеҫ·иҘҝйҹҰдёҖзӣҙиў«еҜ„дәҲеҺҡжңӣ гҖӮ еӣ жӯӨ пјҢ дёҠиҝ°ж¶ҲжҒҜдёҖеҮә пјҢ з«ӢеҚіеј•еҸ‘е№ҝжіӣе…іжіЁ гҖӮ 2жңҲ5ж—Ҙ пјҢ еӣҪеҶ…иҚҜзү©з ”еҸ‘зҡ„зӣёе…ізҹҘжғ…дәәеЈ«гҖҒдё“еҲ©дё“家е’Ңжө·еӨ–еҚҺдәәеӯҰиҖ…жҺҘеҸ—гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢйҮҮи®ҝ пјҢ иҜҰи§Јз ”з©¶жңәжһ„дёәдҪ•з”іиҜ·з‘һеҫ·иҘҝйҹҰдёӯеӣҪдё“еҲ©дёҖдәӢ гҖӮ гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢпјҡз”іжҠҘдё“еҲ©зҡ„вҖңз‘һеҫ·иҘҝйҹҰвҖқжҳҜеҗүеҲ©еҫ·е…¬еҸёз ”еҸ‘зҡ„з‘һеҫ·иҘҝйҹҰеҗ—пјҹ зӣёе…ізҹҘжғ…дәәеЈ«пјҡеҜ№пјҒ гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢпјҡз”іжҠҘиҝҷдёӘдё“еҲ© пјҢ еҪ“ж—¶жҳҜжҖҺд№ҲиҖғиҷ‘зҡ„пјҹ зӣёе…ізҹҘжғ…дәәеЈ«пјҡиҝҷжҳҜеҒҡз§‘з ”зҡ„еҹәжң¬иҰҒжұӮ гҖӮ жҲ‘们жҳҜеҒҡиҚҜзү©з ”究зҡ„ пјҢ еҒҡеҮәж–°жҲҗжһңе°ұдјҡеҺ»з”іиҜ·дё“еҲ© гҖӮ жҲ‘д»¬з ”з©¶еҮәз‘һеҫ·иҘҝйҹҰзҡ„ж–°з”ЁйҖ” пјҢ жңүиҜҒжҚ®иҜҒжҳҺе®ғеңЁдҪ“еӨ–з»Ҷиғһе®һйӘҢдёӯжңүж•Ҳ пјҢ иҝҷиӮҜе®ҡжҳҜеҲ«дәәжІЎжңүеҒҡиҝҮзҡ„ пјҢ жүҖд»ҘжҲ‘们еҸҜд»Ҙз”іиҜ·жӢҘжңүзҹҘиҜҶдә§жқғ гҖӮ иҝҷдёӘдё“еҲ©зҡ„жқғеҲ©иҢғеӣҙжҳҜз‘һеҫ·иҘҝйҹҰеңЁжҠ—ж–°еһӢеҶ зҠ¶з—…жҜ’дёҠзҡ„з”ЁйҖ” гҖӮ дё“еҲ©з”іиҜ·жң¬жқҘе°ұжҳҜвҖң跑马еңҲең°вҖқ пјҢ жҳҜеңЁдҝқжҠӨиҮӘе·ұзҡ„еҲ©зӣҠ гҖӮ зӣ®еүҚдёҙеәҠиҜ•йӘҢжӯЈеңЁиҝӣиЎҢ пјҢ дёҚз®ЎиҜ•йӘҢз»“жһңжҳҜеҗҰиҜҒжҳҺз‘һеҫ·иҘҝйҹҰжңүж•Ҳ пјҢ жҲ‘们йғҪиҰҒз”іиҜ·иҝҷдёӘдё“еҲ© гҖӮ иҝҷз§ҚеҒҡжі•д№ҹжҳҜдёәдәҶдҝқжҠӨеӣҪ家еҲ©зӣҠ пјҢ еҰӮжһңжҲ‘们дёҚжҠўе…ҲжіЁеҶҢиҚҜе“Ғз”ЁйҖ” пјҢ д»ҘеҗҺиҝҷдёӘиҚҜзү©зҡ„дҫӣеә”гҖҒд»·ж јдёҠйғҪдҝқиҜҒдёҚдәҶ гҖӮ еӣҪеӨ–е…¬еҸёжғіз»ҷдҪ иҚҜе°ұз»ҷдҪ иҚҜ пјҢ дёҚжғіз»ҷдҪ иҚҜе°ұдёҚз»ҷдҪ иҚҜ пјҢ жғіиҰҒеӨҡе°‘й’ұе°ұиҰҒеӨҡе°‘й’ұ пјҢ иҝҷж ·дёӯеӣҪеҝ…е°ҶеҸ—еҲ¶дәҺдәә гҖӮ дёӯеӣҪеҰӮжһңжңүдәҶз‘һеҫ·иҘҝйҹҰиҚҜзү©з”ЁйҖ”дё“еҲ© пјҢ е…¶д»–зҡ„дё“еҲ©жҲ‘们еҸҜд»Ҙе’ҢеӣҪеӨ–е…¬еҸёиҝӣиЎҢдәӨеҸүи®ёеҸҜ пјҢ иҝҷд№ҹжҳҜдёҖз§Қи°ҲеҲӨжүӢжі• гҖӮ гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢпјҡжҲ‘еӣҪдё“еҲ©жі•е…Ғи®ёз”ЁйҖ”дё“еҲ©з”іиҜ·е’ҢжҺҲжқғеҗ—пјҹиҝҷз§Қз”ЁйҖ”дё“еҲ©зҡ„з”іиҜ·еёёи§Ғеҗ—пјҹ жқҺеҪ©иҫүпјҲдёүз”ҹеӣҪеҒҘиҚҜдёҡпјҲдёҠжө·пјүиӮЎд»Ҫжңүйҷҗе…¬еҸёзҹҘиҜҶдә§жқғйғЁй«ҳзә§жҖ»зӣ‘пјүпјҡ еҸҜд»Ҙзҡ„ пјҢ еҸӘиҰҒжҳҜе’ҢиҝҮеҺ»зҡ„дё“еҲ©жңүжҳҺжҳҫзҡ„еҢәеҲ«е°ұеҸҜд»Ҙ гҖӮ жҜҸдәәйғҪжңүдё“еҲ©з”іиҜ·зҡ„жқғеҲ© пјҢ дҪҶз”іиҜ·д»ҘеҗҺиғҪдёҚиғҪжү№еҮҶ пјҢ иҝҳеҝ…йЎ»з»ҸиҝҮеӣҪ家зҹҘиҜҶдә§жқғеұҖзҡ„е®ЎжҹҘ гҖӮ е®ЎжҹҘд»ҘеҗҺеҲӨж–ӯ пјҢ з”іиҜ·зҡ„дё“еҲ©жҳҜеҗҰиғҪиҫҫеҲ°жҺҲдәҲдё“еҲ©зҡ„ж–°йў–жҖ§гҖҒеҲӣйҖ жҖ§гҖҒе®һз”ЁжҖ§зҡ„иҰҒжұӮ пјҢ еҰӮжһңдёҚеӨҹзҡ„иҜқжҳҜдёҚеҸҜд»ҘжҺҲжқғзҡ„ гҖӮ иҝҷз§ҚеҒҡжі•дёҚд»…еңЁдёӯеӣҪеёёи§Ғ пјҢ еңЁе“ӘдёӘеӣҪ家йғҪеёёи§Ғ гҖӮ еҢ–еҗҲзү©дё“еҲ©жңү第дёҖз”ЁйҖ” пјҢ е…¶д»–дәәжҲ–дё“еҲ©жқғжң¬дәәиҝҳеҸҜд»Ҙе°ұ第дәҢз”ЁйҖ”з”іиҜ·дё“еҲ© гҖӮ еңЁдё–з•ҢдёҠеҫҲеёёи§Ғзҡ„ гҖӮ гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢпјҡзҺ°еңЁдё“еҲ©з”іиҜ·зҡ„иҝӣеұ•еҰӮдҪ•пјҹ зӣёе…ізҹҘжғ…дәәеЈ«пјҡжҲ‘们1жңҲ21ж—Ҙз”іжҠҘдәҶиҝҷдёӘдё“еҲ© пјҢ зӣ®еүҚиҝҳжІЎжңүжү№дёӢжқҘ гҖӮ дё“еҲ©е®Ўжү№жңүдёӘиҝҮзЁӢ пјҢ дёҖиҲ¬жқҘиҜҙ пјҢ жү№дёӢжқҘйңҖиҰҒдёҖе№ҙе·ҰеҸізҡ„ж—¶й—ҙ гҖӮ дёҚз®ЎжңҖеҗҺиғҪдёҚиғҪжү№дёӢжқҘ пјҢ жҲ‘们иҰҒе…ҲеҚ жңүдё“еҲ©з”іжҠҘзҡ„дјҳе…Ҳжқғ гҖӮ еӣ дёәеңЁз”іжҠҘд№ӢеүҚдёҚиғҪжңүж•°жҚ®е…¬ејҖ пјҢ жүҖд»Ҙи®әж–Үзҡ„еҸ‘иЎЁжҳҜеңЁдё“еҲ©з”іиҜ·д№ӢеҗҺзҡ„ гҖӮ гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢпјҡиҝҷйЎ№дё“еҲ©з”іиҜ·жҳҜ1жңҲ21ж—ҘжҸҗеҮәзҡ„ пјҢ ж’°еҶҷдё“еҲ©еӨ§жҰӮйңҖиҰҒеӨҡй•ҝж—¶й—ҙпјҹ жқҺеҪ©иҫүпјҡеҰӮжһңе…ідәҺж–°йў–жҖ§гҖҒеҲӣйҖ жҖ§гҖҒе®һз”ЁжҖ§зҡ„иө„ж–ҷе……еҲҶзҡ„иҜқ пјҢ еҜ№дәҺдёҖдёӘзү№еҲ«иө„ж·ұзҡ„дё“еҲ©д»ЈзҗҶдәәжқҘиҜҙ пјҢ еҮ дёӘе°Ҹж—¶е°ұеҸҜд»ҘеҶҷеҘҪ гҖӮ еүҚжңҹиө„ж–ҷеҮҶеӨҮ пјҢ еҢ…жӢ¬еҒҡе®һйӘҢзҡ„ж—¶й—ҙиҰҒзңӢе…·дҪ“жғ…еҶө гҖӮ еҒҮеҰӮе°ұдёҖдҫӢз—…дәәжҲ–иҖ…дёӨдҫӢз—…дәәжңүж•Ҳ пјҢ зңӢзҺ°еңЁе…¬ејҖжҠҘйҒ“ пјҢ иҚҜзү©еҸ‘з”ҹдҪңз”Ёзҡ„ж—¶й—ҙд№ҹе°ұжҳҜеҮ еӨ© гҖӮ иҝҷе°ұеҸҜд»Ҙ马дёҠз”іиҜ· пјҢ еҫҲеҝ« гҖӮ гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢпјҡйҖҡеёёжғ…еҶөдёӢ пјҢ еҢ–еӯҰйўҶеҹҹдё“еҲ©д»Һз”іиҜ·еҲ°жҺҲжқғеӨ§жҰӮиҰҒеӨҡй•ҝж—¶й—ҙпјҹжҳҜеҗҰжңүеҸҜиғҪз»ҸиҝҮз»ҝиүІйҖҡйҒ“пјҹ жқҺеҪ©иҫүпјҡжҲ‘дёҚзҹҘйҒ“жӯҰжұүжңүжІЎжңүеҠ еҝ«зЁӢеәҸ гҖӮ еңЁжңүзҡ„еҹҺеёӮжңүеҠ еҝ«зЁӢеәҸ пјҢ еҸҜиғҪеҮ дёӘжңҲе°ұдјҡжҺҲжқғ гҖӮ жӯЈеёёжғ…еҶөдёҚеҒҡеҠ еҝ«зҡ„иҜқ пјҢ дёҖиҲ¬йғҪжҳҜ3~4е№ҙ гҖӮ гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢпјҡжңүеӘ’дҪ“жҠҘйҒ“з§° пјҢ еҗүеҲ©еҫ·еңЁз”іиҜ·дё“еҲ©зҡ„ж—¶еҖҷ пјҢ жҠҠжүҖжңүеҶ зҠ¶з—…жҜ’科йғҪвҖңеҢ…жҸҪвҖқдёӢжқҘдәҶ пјҢ йӮЈеҰӮд»Ҡз”іиҜ·зҡ„дё“еҲ©жҳҜеҗҰиғҪжҲҗз«Ӣе‘ўпјҹ зӣёе…ізҹҘжғ…дәәеЈ«пјҡвҖңеҢ…жҸҪвҖқжҳҜдёҚеҸҜиғҪзҡ„ гҖӮ ж–°еһӢеҶ зҠ¶з—…жҜ’пјҲ2019-nCoVпјүиӮәзӮҺжҳҜ2019е№ҙ12жңҲ20ж—Ҙд№ӢеҗҺжүҚеҮәзҺ°зҡ„з–ҫз—… пјҢ д»ҘеүҚзҡ„дё“еҲ©жҖҺд№ҲеҸҜиғҪеҢ…жӢ¬жңӘжқҘзҡ„гҖҒдәә们жӣҫз»ҸжғіиұЎдёҚеҲ°зҡ„з–ҫз—…е‘ўпјҹ еҪ“ж—¶зҡ„дё“еҲ©еҸӘиғҪеҢ…еҗ«еңЁдё“еҲ©з”іиҜ·д№ӢеүҚеҮәзҺ°зҡ„гҖҒжңүжҠҘйҒ“зҡ„еҶ зҠ¶з—…жҜ’еј•иө·зҡ„з–ҫз—… пјҢ дёҚиғҪеҢ…еҗ«дё“еҲ©з”іиҜ·д№ӢеҗҺж–°еҮәзҺ°зҡ„еҶ зҠ¶з—…жҜ’еј•иө·зҡ„з–ҫз—… гҖӮ жқҺеҪ©иҫүпјҡеҗүеҲ©еҫ·з”іиҜ·зҡ„дё“еҲ©йҮҢжҸҗеҲ°дәҶеә”з”ЁдәҺеҶ зҠ¶з—…жҜ’科зҡ„з”ЁйҖ” пјҢ жүҖд»ҘиҜҙ第дәҢз”ЁйҖ”дё“еҲ©зҡ„еҲӣйҖ жҖ§еҸҜиғҪжҳҜжңүй—®йўҳзҡ„ гҖӮ жүҖжңүзҡ„е®һж–ҪеҠӣе’Ңе®һи·өеҠӣиғҪдёҚиғҪе’ҢеҗүеҲ©еҫ·зҡ„еҶ зҠ¶з—…жҜ’科иҝӣиЎҢеҢәеҲҶ пјҢ иҖҢдё”еҢәеҲҶиғҪдёҚиғҪдә§з”ҹзү№еҲ«еҘҪзҡ„ж•Ҳжһң пјҢ 第дәҢз”ЁйҖ”жҳҜдёҚжҳҜеҸҜд»Ҙд»ҺеҗүеҲ©еҫ·еҢ–еҗҲзү©зҡ„дҪңз”ЁжңәзҗҶдёӯжҺЁзҗҶеҫ—еҲ° пјҢ жІЎзңӢеҲ°з”іиҜ·ж–Үжң¬еҲӨж–ӯдёҚдәҶ гҖӮ гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢпјҡдё“еҲ©жү№еҮҶдёӢжқҘзҡ„еҸҜиғҪжҖ§еӨ§еҗ—пјҹ зӣёе…ізҹҘжғ…дәәеЈ«пјҡеёҢжңӣиӮҜе®ҡжҳҜжңүзҡ„ пјҢ дё“еҲ©е®Ўжү№жҳҜдёҖ件еҫҲеӨҚжқӮзҡ„дәӢжғ… пјҢ жҲ‘们еҸӘиғҪдҝқиҜҒжҲ‘们申иҜ·дәҶ гҖӮ жқҺеҪ©иҫүпјҡд№ҹжңүеҸҜиғҪдёҚдјҡиў«жү№еҮҶ гҖӮ е…·дҪ“иҰҒзңӢе®ғиҜҙжҳҺд№ҰйҮҢйқўе…¬ејҖзҡ„е®һйӘҢж•°жҚ®жҳҜдёҚжҳҜж»Ўи¶ідёӯеӣҪдё“еҲ©жі•жңүе…іж–°йў–жҖ§гҖҒеҲӣйҖ жҖ§е’Ңе®һз”ЁжҖ§зҡ„иҰҒжұӮ гҖӮ еӣ дёәжІЎжңүзңӢеҲ°дё“еҲ©з”іиҜ·ж–Үжң¬ пјҢ жүҖд»ҘиҝҳдёҚеҘҪдҪңеҮәеҲӨж–ӯ гҖӮ дҪҶжҳҜйҖҡеёёжғ…еҶөдёӢ пјҢ дё“еҲ©з”іиҜ·дёӯжҸҗдәӨзҡ„е®һйӘҢж•°жҚ® пјҢ иғҪдёҚиғҪж”ҜжҢҒж–°йў–жҖ§гҖҒеҲӣйҖ жҖ§ пјҢ жҳҜиғҪеҗҰжҺҲжқғзҡ„йҮҚиҰҒеӣ зҙ гҖӮ иҝҷдёӘиҚҜз”ЁдәҺж–°еһӢеҶ зҠ¶з—…жҜ’зҡ„жІ»з–— пјҢ е°ұиҝҷдёӘз”ЁйҖ”жқҘиҜҙ пјҢ ж–°йў–жҖ§еә”иҜҘжІЎд»Җд№Ҳй—®йўҳ пјҢ дё»иҰҒжҳҜеҜ№еҲӣйҖ жҖ§иҰҒжұӮзҡ„й—®йўҳ гҖӮ дё“еҲ©жі•дёӯеҜ№еҲӣйҖ жҖ§зҡ„иҰҒжұӮжҳҜ пјҢ дёҺзҺ°жңүжҠҖжңҜзӣёжҜ” пјҢ иҜҘеҸ‘жҳҺе…·жңүзӘҒеҮәзҡ„е®һиҙЁжҖ§зү№зӮ№е’Ңжҳҫи‘—зҡ„иҝӣжӯҘ пјҢ иҜҘе®һз”Ёж–°еһӢе…·жңүе®һиҙЁжҖ§зү№зӮ№е’ҢиҝӣжӯҘ гҖӮ гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢпјҡеҰӮжһңиҝҷдёӘз”іиҜ·жңҖз»ҲиҺ·еҫ—дәҶжҺҲжқғ пјҢ еҸҜд»ҘжӯЈеёёе®һж–Ҫеҗ—пјҹ жқҺеҪ©иҫүпјҡеҰӮжһңз”іиҜ·жҲҗеҠҹдәҶ пјҢ еҗүеҲ©еҫ·еҰӮжһңе°ҶиҝҷдёӘиҚҜз”ЁдәҺдё“еҲ©жқғеҲ©иҰҒжұӮдҝқжҠӨзҡ„йҖӮеә”з—Ү пјҢ йӮЈд№Ҳе°ұйңҖиҰҒд»Һдё“еҲ©жҢҒжңүиҖ…йӮЈйҮҢжӢҝеҲ°и®ёеҸҜ гҖӮ дҪҶжҳҜеӣ дёәеҗүеҲ©еҫ·жң¬иә«жңүеҢ–еҗҲзү©дё“еҲ© пјҢ йӮЈд№Ҳдё“еҲ©жҢҒжңүиҖ…еҰӮжһң用第дәҢйҖӮеә”з—Үдё“еҲ©зҡ„иҜқ пјҢ дёҖе®ҡйңҖиҰҒеҗүеҲ©еҫ·зҡ„еҢ–еҗҲзү©дё“еҲ©зҡ„и®ёеҸҜ гҖӮ иҝҷжҳҜдёӨдёӘеүҚжҸҗ гҖӮ дёҚиҝҮ пјҢ жҺҲжқғд»ҘеҗҺ пјҢ еҰӮжһңж–°еһӢеҶ зҠ¶з—…жҜ’ж¶ҲеӨұдәҶ пјҢ иҝҷдёӘдё“еҲ©е°ұжІЎз”ЁдәҶ гҖӮ е…¶е®һеңЁSARSжңҹй—ҙ пјҢ жҲ‘们д№ҹз”ҹжҲҗдәҶжҲ‘们иҮӘе·ұзҡ„дёҖдёӘеҢ»жІ»SARSзҡ„дё“еҲ© пјҢ дҪҶжҳҜеҗҺжқҘSARSжІЎжңүдәҶ пјҢ дё“еҲ©д№ҹе°ұжІЎз”ЁдәҶ гҖӮ гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢпјҡдёӯеӣҪзҡ„еҸ‘жҳҺдё“еҲ© пјҢ зҫҺеӣҪдјҡи®Өеҗ—пјҹеҗүеҲ©еҫ·е…¬еҸёеҜ№иҝҷз§ҚеҒҡжі•еҸҚеҜ№дәҶеҗ—пјҹ зӣёе…ізҹҘжғ…дәәеЈ«пјҡйҰ–е…Ҳ пјҢ дё“еҲ©йғҪжңүең°еҹҹжҖ§е’Ңж—¶й—ҙжҖ§ пјҢ дёӯеӣҪзҡ„еҸ‘жҳҺдё“еҲ©иғҪдҝқиҜҒеңЁдёӯеӣҪзҡ„жқғеҲ© гҖӮ 第дәҢ пјҢ е°ҶжқҘжҲ‘们дёҖе®ҡжҳҜиҰҒеҺ»зҫҺеӣҪиө°еҸ‘жҳҺдё“еҲ©зҡ„ пјҢ еҺ»з”іиҜ·PCTпјҲдё“еҲ©еҗҲдҪңеҚҸе®ҡпјү гҖӮ иҝҷз§ҚзҹҘиҜҶдә§жқғжҳҜжҲ‘们еҲӣйҖ еҸ‘жҳҺзҡ„ пјҢ е…·жңүж–°йў–жҖ§гҖҒеҲӣйҖ жҖ§гҖҒе®һз”ЁжҖ§ пјҢ еҗүеҲ©еҫ·еҸҚеҜ№д»Җд№Ҳе‘ўпјҹ гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢпјҡеҰӮжһңиҝҷдёӘз”іиҜ·жңҖз»ҲиҺ·еҫ—дәҶжҺҲжқғ пјҢ еҜ№еҗүеҲ©еҫ·зҡ„з‘һеҫ·иҘҝйҹҰдјҡжңүд»Җд№ҲеҪұе“Қпјҹ жқҺеҪ©иҫүпјҡеҗүеҲ©еҫ·еҸҜд»ҘеңЁз‘һеҫ·иҘҝйҹҰзҡ„иҚҜе“ҒиҜҙжҳҺд№ҰйҮҢиҫ№ пјҢ дёҚеҶҷжІ»з–—ж–°еһӢеҶ зҠ¶з—…жҜ’зҡ„з”ЁйҖ” гҖӮ дҪҶжҳҜеҢ»з”ҹдҪҝз”Ёзҡ„ж—¶еҖҷеҸҜд»Ҙoff label useпјҲиҚҜе“Ғж ёеҮҶж ҮзӨәеӨ–дҪҝз”Ёпјү гҖӮ еҗ„дёӘеӣҪ家зҡ„off label规е®ҡдёҚдёҖж · пјҢ жүҖд»ҘеҲ°ж—¶еҖҷеҸӘиғҪж №жҚ®еҗ„дёӘеӣҪ家зҡ„еҶ…йғЁйҷҗе®ҡжқҘзңӢеҗүеҲ©еҫ·иғҪдёҚиғҪеңЁжҹҗдёӘеӣҪ家绕ејҖиҝҷдёӘдё“еҲ© гҖӮ жҲ‘и§үеҫ—жІЎжңүеҝ…иҰҒжҠҠиҝҷдёӘдё“еҲ©з”іиҜ·еҪ“жҲҗдёҖдёӘдё»иҰҒзҡ„дәӢжғ… гҖӮ жҲ‘дёӘдәәи®Өдёәеә”иҜҘиө¶еҝ«и§ЈеҶіз–«жғ… гҖӮ гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢпјҡвҖңйҖҡиҝҮPCTйҖ”еҫ„иҝӣе…Ҙе…Ёзҗғдё»иҰҒеӣҪ家вҖқж„Ҹе‘ізқҖд»Җд№Ҳпјҹ зӣёе…ізҹҘжғ…дәәеЈ«пјҡжҲ‘еӣҪжҳҜеңЁPCTеӣҪйҷ…дё“еҲ©з»„з»ҮйҮҢзҡ„ пјҢ жҲ‘们еңЁдёӯеӣҪз”іиҜ·дәҶдјҳе…Ҳжқғ пјҢ е°ұж„Ҹе‘ізқҖжҲ‘们иҝӣе…ҘзҫҺеӣҪгҖҒ欧зӣҹгҖҒж—Ҙжң¬зӯүеӣҪ家时 пјҢ еҸҜд»Ҙдә«еҸ—1жңҲ21ж—Ҙз”іиҜ·зҡ„жқғеҲ© гҖӮ жқҺеҪ©иҫүпјҡеӣҪеҶ…дё“еҲ©е’ҢPCTз”іиҜ·дёҚдјҡеҗҢж—¶жҸҗдәӨ гҖӮ дҪҶеҸҜд»ҘеңЁеӣҪеҶ…дё“еҲ©жҸҗдәӨз”іиҜ·еҗҺдёҖе№ҙеҶ…жҸҗдәӨPCTз”іиҜ· гҖӮ PCTеҸӘжҳҜз”іиҜ· пјҢ дёҚжҳҜдёҖз§ҚжҺҲжқғ гҖӮ PCTз”іиҜ·еҗҺ пјҢ дё“еҲ©иҝӣе…Ҙе…¶д»–еӣҪ家пјҲзј–иҖ…жіЁпјҡеңЁе…¶д»–еӣҪ家иҺ·еҫ—дё“еҲ©еҸ·пјүзҡ„ж—¶й—ҙе°ұдјҡз»ҹдёҖжҢүз…§жҸҗдәӨPCTз”іиҜ·зҡ„ж—¶й—ҙ гҖӮ дҪҶйӮЈж—¶жқғеҲ©иҰҒжұӮдәәжӢҘжңүзҡ„д»…жҳҜдё“еҲ©з”іиҜ·жқғ пјҢ дёҚжҳҜдё“еҲ©жқғ гҖӮ PCTз”іиҜ·еҗҺ пјҢ е°ұжӢҘжңүдәҶдјҳе…Ҳжқғ гҖӮ еҗ„дёӘеӣҪ家еҸ—зҗҶдё“еҲ©зҡ„ж—¶еҖҷе®ЎжҹҘе…¶ж–°йў–жҖ§гҖҒеҲӣйҖ жҖ§жҳҜд»Ҙдјҳе…Ҳжқғж—ҘдҪңдёәдёҖдёӘжҢҮж Ү пјҢ дёҚжҳҜд»Ҙе®ғзҡ„з”іиҜ·ж—Ҙ гҖӮ еҰӮжһңеңЁ1жңҲ21ж—Ҙд№ӢеүҚ пјҢ жІЎжңүе…¬ејҖзҡ„дҝЎжҒҜиҜҒжҳҺз‘һеҫ·иҘҝйҹҰжІ»з–—ж–°еһӢеҶ зҠ¶з—…жҜ’зҡ„з–—ж•Ҳ пјҢ йӮЈд№Ҳ1жңҲ21ж—Ҙе°ұжҲҗдёәдјҳе…Ҳжқғж—Ҙ гҖӮ еҗҢж—¶ пјҢ з”ұдәҺз‘һеҫ·иҘҝйҹҰжІ»з–—зҫҺеӣҪ第дёҖдҫӢз—…дҫӢжҳҜеңЁ1жңҲ21ж—Ҙд№ӢеҗҺ пјҢ жүҖд»ҘеҗүеҲ©еҫ·д№ҹдёҚеҸҜиғҪзҺ°еңЁеҺ»з”іиҜ·з¬¬дәҢз”ЁйҖ”дё“еҲ©зҡ„PCTдҝқжҠӨ пјҢ зјәд№Ҹж–°йў–жҖ§ гҖӮ гҖҠдёӯеӣҪ科еӯҰжҠҘгҖӢпјҡжӮЁеҰӮдҪ•зңӢеҫ…дёӯеӣҪдәәз”іиҜ·з‘һеҫ·иҘҝйҹҰеҸ‘жҳҺдё“еҲ©пјҹ е‘ЁиҲңжі°пјҲзҫҺеӣҪеҢ—еҚЎзҪ—жқҘзәіеӨ§еӯҰеҢ»еӯҰеҚҡеЈ«пјүпјҡеҰӮжһңжғіжҠҠдё“еҲ©з•ҷеңЁдёӯеӣҪ пјҢ еҪ“然жҳҜдёӘеҫҲеҘҪзҡ„дәӢжғ… пјҢ дёҚдјҡеҸ—еҲ¶дәҺдәә гҖӮ дҪҶиҝҷж¬Ўдё“еҲ©жҳҜиҜҒжҳҺдҪ“еӨ–з»Ҷиғһе®һйӘҢжңүж•Ҳжһң пјҢ еҰӮжһңиҝӣдёҖжӯҘз”іиҜ·дё“еҲ© пјҢ еҝ…йЎ»жңүдёҙеәҠж•°жҚ® пјҢ иҖҢдё”еЈ°жҳҺиҝҷдёӘиҚҜдёҚеҸҜиғҪз”ЁдәҺжҢЈй’ұ гҖӮ еҜ№дәҺиҝҷз§ҚжҖҘжҖ§зҡ„зӘҒеҸ‘е…¬е…ұеҚ«з”ҹдәӢ件 пјҢ иҝҷдәӣиҚҜзү©еҚідҪҝжҳҜжңүдё“еҲ© пјҢ д№ҹдёҚиғҪдёҚз»ҷеҲ«дәәз”Ё гҖӮ еҰӮжһңз”іиҜ·дё“еҲ©еҗҺ пјҢ еңЁзҙ§жҖҘзӘҒеҸ‘е…¬е…ұеҚ«з”ҹдәӢ件时иҚҜеҺӮйҷҗеҲ¶еҲ«дәәдҪҝз”Ё пјҢ жҲ‘и®ӨдёәжҳҜжңүдјҰзҗҶй—®йўҳзҡ„ гҖӮ з‘һеҫ·иҘҝйҹҰжҳҜе°ҸеҲҶеӯҗиҚҜзү© пјҢ е°Ҹ规模еҗҲжҲҗ并没жңүд»Җд№ҲйҡҫеәҰ пјҢ еҲҶеӯҗејҸд№ҹж—©е°ұе…¬еёғдәҶ гҖӮ д№ӢеүҚдәҢжңҹзҡ„дёҙеәҠиҜ•йӘҢжҳҜеӨұиҙҘзҡ„ пјҢ еҰӮжһңжІЎжңүеңЁдёӯеӣҪиҝҷж¬ЎдёҠ马дёүжңҹдёҙеәҠ пјҢ иҝҷдёӘиҚҜеҹәжң¬е°ұзӣёеҪ“дәҺвҖңеәҹиҚҜвҖқ гҖӮ жҲ‘и®Өдёәзҙ§жҖҘжғ…еҶөдёӢеӣҪ家еә”иҜҘејәеҲ¶д»ҝеҲ¶ пјҢ 并且用д»ҝеҲ¶иҚҜж•‘дәә гҖӮ дҫӢеҰӮжі°еӣҪгҖҒеҚ°еәҰгҖҒеҚ—йқһиҝҷдәӣеӣҪ家д№ҹејәеҲ¶д»ҝеҲ¶жҠ—иүҫж»Ӣз—…зҡ„иҚҜзү© пјҢ еӣ дёә他们иҜҙиҝҷдәӣиҚҜйғҪжҳҜж•‘е‘Ҫз”Ёзҡ„ пјҢ иҝҷз§ҚиЎҢдёәеҸҚиҖҢдјҡйҖјиҝ«е…¬еҸёејҖж”ҫдё“еҲ© гҖӮ жҲ‘们еӣҪеҶ…д№ҹеә”иҜҘйҖҡиҝҮзұ»дјјзҡ„жі•еҫӢ пјҢ еңЁиҝҷз§Қзҙ§жҖҘзҡ„е…¬е…ұеҚ«з”ҹжғ…еҶөдёӢејәеҲ¶д»ҝеҲ¶иҚҜзү© гҖӮ жқҘжәҗпјҡдёӯеӣҪ科еӯҰзҪ‘
жҺЁиҚҗйҳ…иҜ»
-
ж„ҹжӮҹз”ҹе‘Ҫзҡ„ж„Ҹд№үе’Ңд»·еҖјиҜҙиҜҙ?ж„ҹжӮҹз”ҹе‘Ҫзҡ„ж„Ҹд№ү
-
гҖҢ委еҶ…з‘һжӢүгҖҚ委еҶ…з‘һжӢүи¶…4еҚғдёҮе…¬йЎ·иҖ•ең°пјҢзҹіжІ№еӮЁйҮҸдё–з•Ң第дёҖпјҢдёәе•Ҙзҷҫ姓йҘҘиӮ иҫҳиҫҳ
-
йІӨйұј|гҖҗејҖй’“иҠӮгҖ‘ж°”жё©йӘӨйҷҚиҝҺйҡҫдёҠпјҢз»Ҳжңү收иҺ·еҝғиҲ’з•…
-
жңҖиҝ‘еңЁзҹҘд№ҺдёҠеҫҲзҒ«зҡ„д»ҠеҖҹеҲ°пјҢеҲ°еә•жҳҜд»Җд№Ҳдёңдёңпјҹ
-
зҪ‘з»ңжү“еҚ°жңәжҖҺд№Ҳи®ҫзҪ®е…ұдә«жү“еҚ°
-
з„ҰзӮ№еҠұеҝ— зҘқзҰҸеӣ дҪ иҖҢзңҹжҢҡгҖӮжңӢеҸӢпјҢж—©е®үеҝ«д№җпјҢй—®еҖҷеӣ дҪ иҖҢеҠЁжғ…
-
жҖҺд№Ҳж ·жҺ§еҲ¶иҮӘе·ұзҡ„笑声
-
зҰҸе·һеҲ¶йҰҷжүӢиүәдәәзҡ„е®Ҳжңӣпјҡи®©е“ҒйҰҷйҮҚж–°иө°иҝӣеҜ»еёёдәә家
-
еј дёҖйёЈ|иў«зҫҺеӣҪејәд№°пјҢеңЁеӣҪеҶ…жҢЁйӘӮпјҢеј дёҖйёЈеҶ…йғЁеҶҚеҸ‘дҝЎеӣһеә”
-
дёүеӣҪдёӨжҷӢеҚ—еҢ—жңқ|дёүеӣҪж—¶жңҹжӯҰе°ҶзӣҳзӮ№пјҢеҗ•еёғжҺ’第дёҖжІЎдәәиҜҙдёҚжңҚпјҢеј йЈһеҸӘиғҪжҺ’第е…ӯ
-
з©ҝиҲ№иўңйҳІжҺүе°ҸеҰҷжӢӣеӣҫзүҮ з©ҝиҲ№иўңйҳІжҺүе°ҸеҰҷжӢӣ
-
и®ё7з§’и®°еҝҶз«ҹжҳҜдёҖеқ—ж°ҙжіҘпјҒпјҢеҮ еҚҒдёҮд№°зҡ„жө·й»„еҺҹжңЁ
-
жҫҺж№ғж–°й—»|дёӯе…ғзҘӯжү«дёҚеҶҚзғ§зәёпјҢжұҹиҘҝжЁҹж ‘еёӮж°‘з”ЁйІңиҠұд»Јжӣҝ
-
|еҘ№иў«иӘүдёәиҠұж»‘еҘізҘһпјҢеӣ вҖңеҗ»иғёз…§вҖқиө°зәўзҪ‘з»ңпјҢеҰӮд»ҠеҚҙд»ҚжҳҜеҚ•иә«
-
еҢәеҹҹеһӢ|еҶ…еҝ§еӨ–жӮЈ д»Ҡдё–зјҳдёӢеҚҠе№ҙеҰӮдҪ•з ҙеұҖ
-
дёӯеӨ®е№ҝз”өжҖ»еҸ°дёӯеӣҪд№ӢеЈ°еҫ®дҝЎе…¬дј—еҸ·|вҖңж»‘йӣӘдё“еҲ—вҖқдёҚе…Ғи®ёд№ҳе®ўйҡҸиә«жҗәеёҰж»‘йӣӘжқҝпјҹеҺҹеӣ з«ҹжҳҜвҖҰ
-
и…ҫи®Ҝеҫ®еҚҡе°ҶдәҺ9жңҲ28ж—ҘеҒңжӯўжңҚеҠЎ 2020ж–°еӘ’дҪ“иЎҢдёҡзҺ°зҠ¶еҸҠеҸ‘еұ•еүҚжҷҜи¶ӢеҠҝеҲҶжһҗз ”з©¶жҠҘе‘Ҡ
-
жұӮжҺЁиҚҗз”·з”ҹзҡ„第дёҖ瓶йҰҷж°ҙпјҢе°Өе…¶е–ңж¬ўж·Ўж·Ўзҡ„зҡӮйҰҷ
-
гҖҢжӯҰжұүгҖҚжҸҗеүҚдәҶи§ЈпјҒ@жүҖжңүзҰ»й„Ӯдәәе‘ҳпјҡзңҒеҶ…17дёӘй“Ғи·Ҝе®ўз«ҷдёҡеҠЎеҚіе°ҶејҖе§ӢжҒўеӨҚ
-
жҗһ笑йЈҺж°ҙж‘Ҷеёғ第дёҖдәә|еҚҙиў«дёҖе°Ҹе°Ҹзҡ„еҜ№иҒ”йҡҫдҪҸпјҢж•…ж„Ҹзҡ„пјҹпјҢеӨ§жё…第дёҖжүҚеӯҗзәӘжҷ“еІҡйҘұиҜ»иҜ—д№Ұ