新冠肺炎|新冠疫苗12月底上市?药监局:上市硬条件一个都不能少
北京联盟_原标题:新冠疫苗12月底上市?药监局:上市硬条件一个都不能少
新冠疫苗何时上市一直是公众关注的焦点 。
近日 , 中国医药(600056,股吧)集团有限公司党委书记、董事长刘敬桢在接受媒体采访时表示 , 预计今年12月底能够上市 , 北京生物制品研究所的灭活疫苗年产量能达预计将达1.2亿剂 , 武汉生物制品研究所的灭活疫苗年产量能达1亿剂 。
这无疑是一个令人振奋的好消息 。
不过 , 对于新冠疫苗的上市 , 作为监管部门 , 国家药监局也推出了科学审批程序 , 只有满足疫苗研发硬条件的新冠疫苗才有上市可能 。
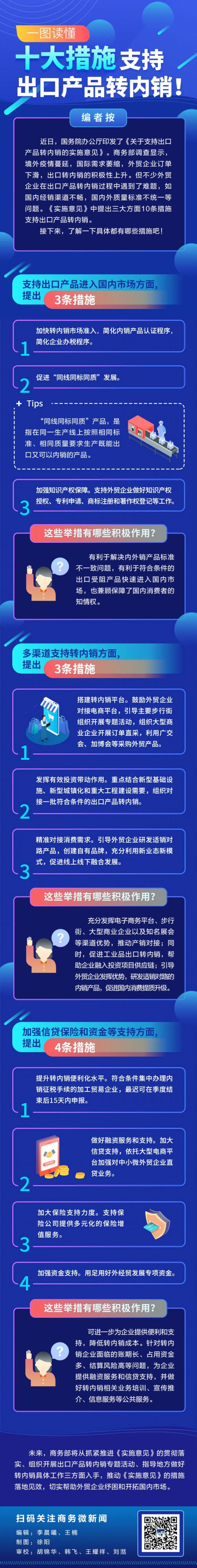
日前 , 为加强对新冠疫苗临床评价的指导 , 推动新冠疫苗尽快上市 , 参考世卫组织发布的目标产品特性(TPP) , 国家药监局药审中心发布了《新型冠状病毒预防用疫苗研发技术指导原则(试行)》(下称《指导原则》)等5个相关通告 , 提出了对疫苗安全性和有效性评价的具体要求 。
上市硬条件
相关的5个《指导原则》通告详述了疫苗上市前的硬条件:
首先是适用人群 。 目前资料显示 , 所有年龄段人群均对SARS-CoV-2病毒易感 , 需要大规模接种以形成群体免疫屏障和阻断传播 。 《指导原则》要求候选新冠疫苗最好能适用于所有年龄段 , 包括孕妇及哺乳期女性;至少应适用于成年人 , 包括老年人 。
其次是安全性 , 疫苗是用于健康人群预防疾病的特殊药品 , 因此疫苗本身的安全性应该是最基本的底线 , 通常需要在大规模临床试验中进行观察 。
第三是保护效力和保护持久性 。 《指导意见》要求有效性评价的主要终点应为预防COVID-19发病 。 以安慰剂为对照的试验 , 目标人群的保护效力最好能达到70%以上(点估计值) , 至少应达到50%(点估计值) , 95%置信区间下限不低于30% 。 同时要求疫苗最好能提供1年及以上的保护 , 至少提供6个月的保护 。 对于保护效力的验证 , 《指导原则》要求新冠疫苗的保护效力应通过Ⅲ期临床保护效力试验进行评价 。 这意味着 , 所有疫苗必须进行临床三期实验才有最终获批的可能 。
此外 , 由于中国新冠肺炎的疫情处于平稳期 , 临床试验需要在发病地区进行 。 《指导意见》也明确了 , 在境外展开临床实验的数据可以作为境内上市依据 。 按照《药品注册管理办法》、《接受药品境外临床试验数据的技术指导原则》等相关要求 , 用于疫苗评价的数据无论来源于境内还是境外临床试验 , 经评估 , 数据来源、数据质量和试验结果均符合要求的 , 可考虑作为支持疫苗在境内上市的重要依据 。
“这些文件明确了疫苗研发的基本硬条件 , 虽然在疫情当前需要加速 , 但是不能弯道超车 。 在疫苗领域 , 没有临床三期试验的数据 , 不能批给上市许可 , 否则这是对人类健康的不负责 。 ” 国际疫苗研究院( International Vaccine Institute)高级专家、原世界卫生组织疫苗与免疫高级医学官员杜玉平表示 。
截至8月10日 , 世界卫生组织统计显示 , 进入临床试验的新冠疫苗有28个 , 临床前研究的疫苗多达139个 , 甚至有些疫苗已经进入三期临床试验 。 这些研究成果 , 无论是从出现时间还是从数量看 , 都是前所未有的 。
在中国新冠疫苗研发的5条技术路线中 , 中生集团以及科兴中维两家灭活疫苗的研发已经从小动物实验、大动物实验以及I/II期临床试验 , 走到了临床三期试验阶段 。 最早进入临床实验的人腺病毒载体重组新冠病毒疫苗在结束临床II期试验后 , 已于6月25日获得中央军委后勤保障部卫生局颁发的军队特需药品批件 , 有效期1年 。 而临床三期试验的启动工作目前尚未有消息透露 。
临床前研究硬条件
除了新冠疫苗上市《指导原则》之外 , 国家药监局还发布了《新型冠状病毒预防用疫苗非临床有效性研究与评价技术要点(试行)》(下称《技术要点》) , 要求新冠疫苗开展临床前试验 , 需要有疫苗的免疫原性、体内保护力等药效学研究数据 。
推荐阅读
- 遏制新冠肺炎传播 乌干达政府封锁一个容纳12万名难民的难民营
- 巴基斯坦新增新冠肺炎确诊病例319例,累计295372例
- 里昂|【世界杯冠军又一手牌?】又是因为新冠,可惜了这位小将
- 印尼新冠肺炎新增确诊病例3308例再创新高,累计169195例
- 病例|香港新增18例新冠肺炎确诊病例,累计确诊4786例
- 新冠|麦考尔报告政治化新冠疫情的谎言与事实真相
- 合作|独家|NRC称与康希诺合作窗口已关闭 康希诺寻求海外批准疫苗
- 新冠肺炎_国际|驻圣克鲁斯总领事王家雷会见圣克鲁斯省省长科斯塔斯
- 陆丰市:南塘镇风险等级由中风险调整为低风险
- 香港新增18例新冠肺炎确诊病例 累计确诊4786例