иҗҪдёӢ|з”Ё20е№ҙиҝҪиө¶зҫҺеӣҪпјҢдёӯеӣҪеҲ¶иҚҜиҝҳиҗҪдёӢеӨҡиҝңпјҹ
ж–Үз« еӣҫзүҮ
йҷҶеӢҮд»Һ2004е№ҙејҖе§ӢеҒҡеҚ°еәҰж јеҲ—еҚ«вҖңд»ЈиҙӯвҖқпјҢиҖҢд»Ҙд»–дёәеҺҹеһӢзҡ„з”өеҪұгҖҠжҲ‘дёҚжҳҜиҚҜзҘһгҖӢеңЁ2018е№ҙдёҠжҳ еҗҺпјҢ收иҺ·дәҶжһҒй«ҳзҡ„иҜқйўҳеәҰгҖӮ
究其еҺҹеӣ пјҢжҳҜз”ұйҮҚз—ҮжҲ–зҪ•и§Ғз—…з—…жӮЈз”ЁиҚҜйҡҫеҫ—дҝқйҡңзҡ„зҺ°е®һеј•иө·зҡ„е…ұйёЈгҖӮ
20дё–зәӘеҲқпјҢеҜ№иҝҷдәӣжӮЈиҖ…жқҘи®ІпјҢеӣҪеҶ…зҡ„иҚҜдјҒе°ҡдёҚиғҪдҫӣз»ҷз»ӯе‘Ҫзҡ„иҚҜпјҢж‘ҶеңЁд»–们йқўеүҚзҡ„еҸӘжңүдёӨдёӘйҖүжӢ©пјҡиҠұеӨ§д»·й’ұд№°з»ҸиҝҮеӣҪ家иҚҜзӣ‘еұҖжү№еҮҶзҡ„иҝӣеҸЈеҺҹз ”иҚҜпјҢиҰҒд№Ҳе°ұзӯүжӯ»гҖӮжҜ•з«ҹеғҸйҷҶеӢҮзЎ®иҜҠд№ӢеҲқжңҚз”Ёзҡ„ж јеҲ—еҚ«пјҢдёҖзІ’иҚҜе°ұиҰҒ200еқ—пјҢдёҖеӨ©е°ұжҳҜ800еӨҡе…ғгҖӮ
д»ҺдјҒдёҡи§’еәҰжқҘзңӢпјҢвҖң10е№ҙ10дәҝзҫҺе…ғвҖқз ”еҸ‘зҡ„дёҖж¬ҫиҚҜпјҢдё“еҲ©дҝқжҠӨжңҹеҸӘжңүзҹӯзҹӯ20е№ҙпјҢиҚҜд»·дҪҺдёҚеҫ—пјҢеӣ дёәвҖңз ”еҸ‘жҠ•е…ҘеҫҖеҫҖдјҡеҚ еҲ°й”Җ售收е…Ҙзҡ„20%д»ҘдёҠвҖқпјҢжңүдёҡеҶ…дәәеЈ«е‘ҠиҜүиҷҺе—…гҖӮ
ж–Үз« еӣҫзүҮ
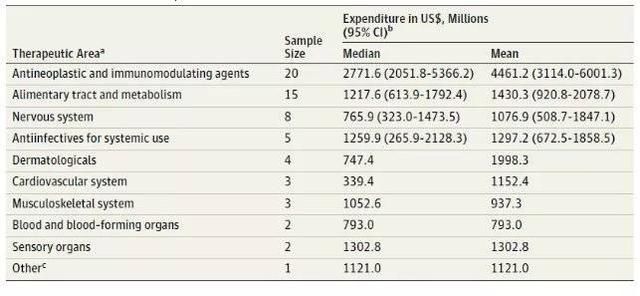
дёҚеҗҢз–ҫз—…иҚҜзү©зҡ„й«ҳйўқз ”еҸ‘жҠ•е…Ҙ
жҢүзҗҶжқҘи®ІпјҢеӣҪеҶ…зҡ„з ”еҸ‘жҲҗжң¬зӯүеҸҜд»ҘжҠҳдёӘжұҮзҺҮпјҢиҚҜд»·иҮӘ然иғҪжӣҙе®һжғ пјҢдҪҶзҺ°е®һжҳҜпјҢеҪ“ж—¶жІЎжңүиҚҜдјҒеҒҡиҝҷ件дәӢпјҢжҲ–иҖ…иҜҙжІЎжңүдәәж„ҝж„ҸеҒҡгҖӮвҖңеӨҡиӢҰе•ҠпјҢзҶ¬йӮЈд№ҲеӨҡе№ҙжҗһз ”еҸ‘пјҢиҝҳжңүеҫҲеӨ§жҰӮзҺҮеӨұиҙҘпјҲд»ҺдёҙеәҠIжңҹиө°еҲ°дёҠеёӮзҡ„жҲҗеҠҹзҺҮеҸӘжңүдёҚи¶і10%пјүпјҢе“ӘжңүеҒҡд»ҝеҲ¶иҚҜжқҘй’ұеҝ«еҸҲзЁівҖқвҖ”вҖ”иҝҷжҳҜеҪ“е№ҙдёҖжү№иҚҜдјҒиҖҒжқҝзҡ„зңҹе®һеҶ…еҝғеҶҷз…§гҖӮ
жј«й•ҝзҡ„дёҖж®өж—¶й—ҙдёӯпјҢд№ҹйІңжңүVCиӮҜеҶ’зқҖжү“ж°ҙжјӮзҡ„йЈҺйҷ©пјҢйҷӘзқҖдёҖж¬ҫиҚҜд»Һз»“жһ„и®ҫи®Ўйҳ¶ж®өдёҖжӯҘжӯҘиө°еҲ°дёҙеәҠгҖҒдёҠеёӮгҖӮеҪ“然пјҢеҹәйҮ‘еӯҳз»ӯжңҹеҜ№д»–们жқҘи®Ід№ҹжҳҜжІЎжі•йҖҫи¶Ҡзҡ„йёҝжІҹгҖӮ
иҖҢзәөи§Ӯиҝ‘еҮ е№ҙпјҢе°Өе…¶еңЁ2018е№ҙжёҜиӮЎж–°и§„еҸҠ2019е№ҙ科еҲӣжқҝжҺЁеҮәеҗҺпјҢеҲӣж–°иҚҜдјҒзҡ„жӢӣзүҢеӣ дёәжңүдәҶиө„жң¬еёӮеңәзҡ„е…іжіЁиҖҢи¶ҠжқҘи¶Ҡдә®гҖӮ
зҷҫжөҺзҘһе·һгҖҒеҶҚйјҺеҢ»иҚҜгҖҒдј еҘҮз”ҹзү©зӯүз”ҹзү©еҢ»иҚҜе…¬еҸёжҲҗеҠҹиөҙзҫҺIPOзҡ„дәӢе®һпјҢз–«жғ…д№ӢдёӯжҲ‘еӣҪеңЁз–«иӢ—дёҠзҡ„иҝӣеәҰпјҢжҳҜжӣҙжө“зҡ„дёҖй’ҲйёЎиЎҖвҖ”вҖ”иҝҷдјјд№ҺеңЁе‘ҠиҜүжҲ‘们пјҢдёӯеӣҪзҡ„еҢ»иҚҜеҲӣж–°е·Із»ҸжӯЈејҸдёҺзҫҺеӣҪжҺҘиҪЁдәҶгҖӮ
然иҖҢпјҢдёӨеӣҪд№Ӣй—ҙжӣҫз»Ҹ15~20е№ҙзҡ„е·®и·қзңҹиғҪиў«иҝҷж ·иҪ»жқҫж¶ҲзҒӯеҗ—пјҹжҲ‘еӣҪеҲӣж–°иҚҜзҡ„иҝӣеұ•еҲ°еә•еҰӮдҪ•пјҹжҲ‘们иҜ•еӣҫд»ҺиҘҝж№–еӨ§еӯҰзҡ„з”ҹзү©еҢ»иҚҜдё»йўҳжҖқдә«жұҮдёӯжүҫеҲ°зӯ”жЎҲгҖӮ
иӣ®иҚ’
е…ҲжҠӣеҮәз»“и®әпјҢиҮӘ2015е№ҙжҲ‘еӣҪеҲӣж–°иҚҜз ”еҸ‘驶е…Ҙеҝ«иҪҰйҒ“еҗҺпјҢжҲ‘们зҡ„зЎ®зј©зҹӯдәҶдёҺзҫҺеӣҪзҡ„е·®и·қгҖӮеӨҡдҪҚжҠ•иө„дәәеҗ‘иҷҺе—…иЎЁзӨәпјҢзӣ®еүҚиҝҷдёҖе·®и·қеңЁ10е№ҙе·ҰеҸіпјӣд№җи§ӮиҖ…еҲҷи®ӨдёәеҸӘжңү5е№ҙгҖӮ
2001е№ҙеӣһеӣҪеҲӣеҠһиҙқиҫҫиҚҜдёҡж—¶пјҢдёҒеҲ—жҳҺеҸ‘зҺ°дёӯеӣҪеҢ»иҚҜдә§дёҡд»ҺеҲӣж–°и§’еәҰжқҘи®ІжҳҜдёҖз©·дәҢзҷҪгҖӮвҖңж•ҙдёӘдә§дёҡд»Ҙд»ҝеҲ¶дёәдё»пјӣжҲ‘们зҡ„дә§еҖјд№ҹдёҚй«ҳпјҢеҸӘжңүзҫҺеӣҪзҡ„1/3гҖӮвҖқ
еҪјж—¶пјҢе…ЁеӣҪжңү6000еӨҡ家иҚҜдјҒпјҢдҪҶ98%д»ҘдёҠеңЁеҒҡд»ҝеҲ¶иҚҜгҖӮеҚідҫҝжҳҜдёӯеӣҪйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖпјҲCFDAпјүйҖҡиҝҮзҡ„1зұ»ж–°иҚҜпјҢд№ҹеҮ д№Һе…ЁжҳҜеҜ№ж¬§зҫҺиҚҜе“Ғзҡ„ж”№иүҜпјҢжҠҖжңҜеҗ«йҮҸеҫҲдҪҺгҖӮ
еҰӮеүҚж–ҮжүҖиҝ°пјҢиө„жң¬дёҚж•ўе…ҘеңәпјҢеҒҡеҲӣж–°иҚҜзҡ„е·ЁйўқжҠ•е…ҘдјҒдёҡиҰҒд№Ҳж”Ҝж’‘дёҚиө·пјҢиҰҒд№ҲжӢ…еҝғеҪұе“ҚеҲ©ж¶ҰгҖӮ
дёҚд»…еҰӮжӯӨпјҢж”ҝзӯ–法规д№ҹжҳҜжһҒеӨ§зҡ„жҢ‘жҲҳгҖӮд»ҺжіЁеҶҢз®ЎзҗҶеҲ°дёҙеәҠз ”з©¶жҢҮеҜји§„иҢғзҡ„ж•ҙеҘ—иҚҜе“Ғз®ЎзҗҶдҪ“зі»е…ЁеғҸжҳҜдёәд»ҝеҲ¶иҚҜиҖҢи®ҫпјҢдёҒеҲ—жҳҺзӯү2000е№ҙеүҚеҗҺеӣһеӣҪжғіеҒҡеҲӣж–°иҚҜпјҢйқўеҜ№зҡ„жҳҜзңҹжӯЈж„Ҹд№үдёҠзҡ„вҖңиӣ®иҚ’вҖқгҖӮ
зӣҙжҺҘз»“жһңдҫҝжҳҜпјҢеӣҪеҶ…дёӨдёүе№ҙд№ҹжІЎжңүдёҖж¬ҫж–°иҚҜдёҠеёӮпјӣеҚідҫҝжңүпјҢд№ҹеӨ§еӨҡжҳҜжңӘз»Ҹ科еӯҰи·Ҝеҫ„йӘҢиҜҒзҡ„гҖӮиӯ¬еҰӮжқӯе·һдёҖж¬ҫеҸ«еҒҡеә·зҫҺжқҘзҡ„иҚҜпјҢиҜҙжҳҜиғҪжІ»з–—иӮәзҷҢпјҢдҪҶз”ЁдәҶеҲ°еә•жңүе“Әдәӣж•ҲжһңпјҢи°ҒйғҪиҜҙдёҚжё…жҘҡгҖӮ
еҸҚи§ӮзҫҺеӣҪпјҢVCе’Ңй«ҳж Ўзҡ„й…ҚеҗҲе·Із»ҸжңүдәҶеҚҒеҲҶзҡ„й»ҳеҘ‘гҖӮй«ҳж ЎиҒҡз„ҰдәҺеҹәзЎҖз ”з©¶пјҢжүҖз ”еҸ‘зҡ„еҲӣж–°иҚҜжҲ–еҸ‘зҺ°зҡ„йқ¶зӮ№еңЁз»ҸиҝҮдёҙеәҠеүҚйӘҢиҜҒеҗҺпјҢVCдјҡжҠ•й’ұпјҢеҶҚй…ҚеӨҮиҒҢдёҡз»ҸзҗҶдәәеӣўйҳҹпјҢе®ҢжҲҗжҲ‘们常иҜҙзҡ„з§‘з ”жҲҗжһңиҪ¬еҢ–гҖӮ
еҗҢж—¶пјҢзҫҺеӣҪеҰӮиҫүз‘һгҖҒиөӣиҜәиҸІгҖҒиҜәеҚҺзӯүеҲ¶иҚҜе·ЁеӨҙзҡ„еӯҳеңЁпјҢи®©дёӯе°Ҹе…¬еҸёжңүеҗ„з§Қж–№жі•иөҡй’ұз»ҙжҢҒз”ҹи®ЎпјҢиӯ¬еҰӮжҠҖжңҜжҺҲжқғгҖҒеҮәе”®й”Җе”®д»ЈзҗҶжқғгҖҒ被并иҙӯзӯүгҖӮиғҢеҗҺзҡ„VCд№ҹеӣ жӯӨжңүдәҶйҷӨдёҠеёӮд№ӢеӨ–жӣҙдё°еҜҢзҡ„йҖҖеҮәжңәеҲ¶гҖӮ
дёҚиҝҮеҚідҪҝзңӢеҲ°дәҶе·®и·қпјҢеӣҪеҶ…зҡ„зЎ®жІЎжңүеҗҲйҖӮзҡ„з”ҹеӯҳзҺҜеўғз•ҷз»ҷеҲӣж–°иҚҜгҖӮеӣ иҖҢйІңжңүеҲӣдёҡиҖ…иӮҜеҶ’йҷ©иҝҪиө¶гҖӮ
ж•°йҮҸиҝҪиө¶пјҢиҚҜиҙ№йҷҚдҪҺ
иҪ¬жҠҳзӮ№е§ӢдәҺ2015е№ҙеӣҪ家йҷҶз»ӯжҺЁеҮәзҡ„иҚҜе“ҒжіЁеҶҢзӯүзӣёе…іж”ҝзӯ–гҖӮдҪҶзӣҙеҲ°2017е№ҙпјҢжҲ‘еӣҪжүҚејҖе§ӢеҜ№зңҹжӯЈзҡ„еҲӣж–°иҚҜз»ҷдәҲж”ҝзӯ–ж”ҜжҢҒпјҢдёҙеәҠиҜ•йӘҢз®ЎзҗҶгҖҒе®ЎиҜ„е®Ўжү№жөҒзЁӢзӯүжүҚејҖе§Ӣе®Ңе–„гҖӮ
ж”ҝзӯ–зәўеҲ©д№ӢдёӢпјҢзғӯй’ұж¶Ңе…ҘиҝҷдёӘиөӣйҒ“гҖӮеҲӣж–°иҚҜжҖ»з®—жңүдәҶеҹәжң¬зҡ„жҲҗй•ҝзҺҜеўғгҖӮ
еңЁдёҒеҲ—жҳҺзңӢжқҘпјҢ2018е№ҙд№ӢеҗҺпјҢжҲ‘еӣҪзҡ„еҲӣж–°иҚҜзү©иҝӣе…ҘдәҶзҲҶеҸ‘жңҹгҖӮвҖңжҲ‘们дёҖе№ҙиғҪеҮә10дёӘж–°иҚҜпјҢиҷҪ然дёҚеҘҪиҜҙжҳҜдёҚжҳҜжҜҸдёӘеҲӣж–°иҚҜйғҪеҫҲеҘҪпјҢдҪҶд»Һж•°йҮҸдёҠжқҘзңӢпјҢжҲ‘们и·ҹе…Ёзҗғзҡ„е·®и·қе·Із»ҸеӨ§еӨ§зј©е°ҸгҖӮвҖқ
вҖңеҗҺз»ӯжҲ‘们д№ҹиғҪзңӢеҲ°йқһеёёеҘҪзҡ„еҠҝеӨҙгҖӮвҖқжҚ®дёҒеҲ—жҳҺд»Ӣз»ҚпјҢиҝ‘еҮ е№ҙжҲ‘еӣҪжҜҸе№ҙжіЁеҶҢдёҙеәҠиҜ•йӘҢзҡ„йЎ№зӣ®жңүеҮ зҷҫдёӘпјҢе“ӘжҖ•еҸӘжңү10%зҡ„жҲҗеҠҹзҺҮпјҢд№ҹж„Ҹе‘ізқҖд»ҘеҗҺеҸҜиғҪжҜҸе№ҙйғҪжңү20~30дёӘж–°иҚҜеҸҜд»Ҙиө°еҲ°дёҠеёӮгҖӮ
дёҚд»…еҰӮжӯӨпјҢеӣҪеҶ…зҡ„йғЁеҲҶеҲӣж–°иҚҜдёҚеҶҚжҳҜиҮӘеЁұиҮӘд№җгҖӮ
вҖңжҲ‘们зҡ„жҠҖжңҜе№іеҸ°е’Ңз”ҹдә§иғҪеҠӣпјҢйҖҗжёҗиғҪеӨҹиў«и·ЁеӣҪиҚҜдјҒзңӢдёӯпјҢеңЁеӣҪеӨ–жҺҲжқғпјҢиҝҷиҜҒжҳҺдәҶжҲ‘们жҠҖжңҜиғҪеҠӣзҡ„жҸҗеҚҮвҖқпјҢиҝҷжҳҜи®©жё…еҚҺеӨ§еӯҰеҢ»еӯҰйҷўйҷўй•ҝи‘ЈжҷЁж¬Је–ңзҡ„еҸҳеҢ–д№ӢдёҖгҖӮ
иҝҷеҜ№иҚҜдјҒжқҘи®ІпјҢ д№ҹж„Ҹе‘ізқҖеҮ еҚғдёҮзҫҺе…ғпјҢз”ҡиҮіеҮ дәҝзҫҺе…ғзңҹйҮ‘зҷҪ银зҡ„иҝӣиҙҰгҖӮ
еҸҰдёҖж–№йқўпјҢеҫҲеӨҡеӣҪеҶ…еҲӣж–°иҚҜд№ҹеңЁиө°еҗ‘еӣҪйҷ…вҖ”вҖ”еңЁеӣҪеӨ–иҝӣиЎҢдёҙеәҠз ”з©¶пјҢеңЁеӣҪеӨ–дёҠеёӮгҖӮжӯӨеүҚзҷҫжөҺзҘһе·һжүҖз ”еҸ‘зҡ„зҷҪиЎҖз—…е°ҸеҲҶеӯҗиҚҜжіҪеёғжӣҝе°јпјҢе°ұе·ІеңЁзҫҺеӣҪиҺ·жү№гҖӮ

ж–Үз« еӣҫзүҮ
жіҪеёғжӣҝе°јиҝҳжңүдёҖзі»еҲ—йҖӮеә”з—Үзҡ„дёҙеәҠиҜ•йӘҢеңЁи·ҜдёҠ
дёӯеӣҪзҡ„иҚҜдјҒд№ҹејҖе§Ӣе…·жңүдәҶе°ҶеӣҪеӨ–з ”з©¶жҲҗжһңйҖҡиҝҮжҠҖжңҜеҗҲдҪңгҖҒиҙӯд№°жҺҲжқғгҖҒжҲҳз•Ҙ并иҙӯзҡ„ж–№ејҸеј•е…ҘдёӯеӣҪпјҢд»ҺиҖҢжӢүиҝ‘дёҺеӣҪйҷ…еүҚжІҝз ”з©¶зҡ„и·қзҰ»гҖӮ
жҺЁиҚҗйҳ…иҜ»
- еұұдёң|жҺўзҙўйқ’е№ҙеӯҰз”ҹеҠ©еҠӣд№Ўжқ‘жҢҜе…ҙж–°жЁЎејҸпјҢ2020е№ҙвҖңжё…еҚҺеӯҰеӯҗеұұдёңиЎҢвҖқеңҶ满收е®ҳ
- е°Ҹеӣӣзҡ„еЁұд№җ|еӣҪ家дёҖзә§жј”е‘ҳйӮөеі°пјҡйҷӘеҰ»еӯҗеҜ№жҠ—з—…йӯ”20е№ҙпјҢеҰӮд»Ҡж»Ўи„ёз–ҷзҳ©еӨҙеҸ‘иҠұзҷҪ
- ж ҮеҮҶең°еӣҫ|2020е№ҙж ҮеҮҶең°еӣҫеҸ‘еёғпјҢ дёҖзӮ№йғҪдёҚиғҪй”ҷпјҒ
- 2020|йқ’еІӣ银иЎҢе…¬еёғ2020е№ҙдёӯжңҹдёҡз»©пјҡ иө„дә§жҖ»йўқи¶…4405дәҝе…ғ жҢҒз»ӯзЁіеҒҘеўһй•ҝ
- 2020|жү©ж•Је‘ЁзҹҘпјҒиҮӘ然иө„жәҗйғЁпјҡ2020е№ҙж ҮеҮҶең°еӣҫеҸ‘еёғ
- еҗҢзЁӢ|еҗҢзЁӢиүәйҫҷ2020е№ҙдёҠеҚҠе№ҙиҗҘ收22дәҝе…ғпјҢзҺӢејәи°ғд»»йҰ–еёӯиҝҗиҗҘе®ҳ
- иҪ¬еӯҳпјҒиҮӘ然иө„жәҗйғЁеҸ‘еёғ2020е№ҙж ҮеҮҶең°еӣҫ
- иҮӘ然иө„жәҗ|иҪ¬еӯҳпјҒиҮӘ然иө„жәҗйғЁеҸ‘еёғ2020е№ҙж ҮеҮҶең°еӣҫ
- ж•ҷиӮІ|жҫ§еҺҝе°ҸжёЎеҸЈй•ҮдёӯеӯҰдёҫеҠһ2020е№ҙж•ҷеёҲжҡ‘жңҹеҹ№и®ӯзҸӯ
- еҝғиҝһеҝғ|вҖңеҝғиҝһеҝғвҖқж…°й—®жј”еҮәиөҙж№–еҚ—еҚҒе…«жҙһжқ‘















![[еҲҳе§ҡе°§зҡ„ж–Үеӯ—еҹҺе Ў]1зәӘеҪ•еҲӣ80еҗҺеҺҶеҸІпјҢдёҒдҝҠжҷ–з»Ҳиҝӣж–ҜиҜәе…ӢTOP10пјҒ1йЎ№жҺ’еҗҚй«ҳеұ…第5](https://imgcdn.toutiaoyule.com/20200410/20200410064922907030a_t.jpeg)


